Nội dung chính
- 1 Cẩm nang chẩn đoán bệnh cây – P6: Quy trình và thiết bị làm việc trong khu vực phòng thí nghiệm
- 1.1 1/ Kiểm tra mẫu bệnh trong khu vực phòng thí nghiệm
- 1.2 2/ Kính lúp soi nổi và kính hiển vi
- 1.3 3/ Phân lập nấm tạo bệnh
- 1.4 4/ Cấy truyền từ những đĩa phân lập
- 1.5 5/ Làm thuần mẫu nấm
- 1.6 6/ Nhận biết những mẫu nấm thuần
- 1.7 7/ Giám định nấm tạo bệnh
- 1.8 8/ Tài liệu tham khảo
- 1.9 Cuốn cẩm nang này được sắp xếp thành những phần sau:
Cẩm nang chẩn đoán bệnh cây – P6: Quy trình và thiết bị làm việc trong khu vực phòng thí nghiệm

P1 | P2 | P3 | P4 | P5 | P6 | P7 | P8 | P9 | P10 | P11 | P12 | P13 | P14
Trong phần này, những chia sẻ cách được đưa ra nhằm trợ giúp những cán bộ mới vào nghề, giúp họ phát triển các kỹ năng cấp thiết cho một cán bộ chẩn đoán bệnh cây, bao gồm những cách:
- Sử dụng kính hiển vi
- Phân lập
- Cấy truyền
- Làm thuần
- Giám định
- Truyền bệnh nhân tạo.
Với kinh nghiệm của bản thân, cán bộ chẩn đoán bệnh cây có khả năng thay đổi những quy trình sao cho rất hiệu quả nhất. Những cách thức bảo quản mẫu nấm sống, những công thức nấu môi trường nuôi cấy và nguyên tắc cũng như biện pháp tiệt trùng được trình bày ở Phụ lục 3/
1/ Kiểm tra mẫu bệnh trong khu vực phòng thí nghiệm
Các quy trình sau đây được ứng dụng để kiểm tra các cây có dấu hiệu héo, còi cọc và bệnh trên lá. Bước giai đoạn đầu là xem xét cẩn trọng tất cả cây và so sánh các để ý này với các để ý trên ruộng đồng.
1/1 Héo và còi cọc
Nếu cây bị héo và còi cọc, khả năng có nguyên do từ bệnh héo do tắc bó mạch hoặc thối thân hoặc rễ.
-
Kiểm tra sự hóa nâu của mạch dẫn
(a) Nếu mạch dẫn hóa nâu, có thể là bệnh héo do nấm hoặc vi khuẩn. Kiểm tra dịch khuẩn.
• Nếu có dịch khuẩn, chuẩn bị đĩa cấy khuẩn.
• Nếu như không có dịch khuẩn, có thể là bệnh héo Fusarium hoặc
Verticillium. Cấy phần thân hóa nâu ra đĩa để phân lập nấm.
(b) Nếu mạch dẫn không hóa nâu, có thể là bệnh thối rễ hoặc thân do nấm thực hoặc một loài giống nấm hoặc tuyến trùng gây nên. (Ghi chú: nên kiểm tra thêm những dấu hiệu do virút chính vì một vài virút tạo bệnh cũng gây dấu hiệu héo và còi cọc.)
-
Kiểm tra tìm hạch và sợi nấm
(a) Nếu có hạch, tìm cách phân lập Sclerotinia sclerotiorum, S. rolfsii hoặc Rhizoctonia spp. dựa trên hình thức biểu hiện ra bên ngoài loại hạch để ý được.
(b) Nếu như không có hạch, có thể là bệnh thối rễ, tuyến trùng hoặc sưng rễ ở cây họ thập tự.
-
Kiểm tra tìm bằng chứng bệnh tuyến trùng (nốt sưng rễ hoặc vết loét rễ).
(a) Nếu có, tách tuyến trùng ra để xác định nguyên nhân tạo bệnh và gửi đến một phòng thí nghiệm tuyến trùng để giám định loài.
(b) Nếu như không có, và có thối rễ (màu nâu), tìm cách phân lập nấm hoặc nguyên nhân giống nấm tạo bệnh
1/2 Những bệnh ở lá
Nếu lá có những biểu hiện bệnh, kiểm tra vết bệnh dưới một kính lúp soi nổi.
-
Kiểm tra tìm dấu hiệu khảm, vằn, lá cuốn hoặc lá còi.
(a) Nếu có, có thể là bệnh do virút. Gửi mẫu bệnh đến một phòng thí nghiệm chẩn đoán virút thực vật. (Ghi chú: biến vàng và đốm cũng có khả năng do virút gây nên, ví dụ như virút đốm vòngđu đủ và virút đốm héo cà chua.)
(b) Nếu như không có, có thể nguyên nhân tạo bệnh là nấm hoặc vi khuẩn.
-
Kiểm tra tìm đốm lá xanh trong dạng giọt dầu, cháy lá hoặc dịch khuẩn.
(a) Nếu có, có thể nguyên nhân tạo bệnh là vi khuẩn. Phân lập bằng phương pháp cấy dịch khuẩn từ nhựa cây lên môi trường King’s B.
(b) Nếu như không có, có thể nguyên nhân tạo bệnh là nấm.
-
Kiểm tra tìm những cấu trúc nấm dưới kính lúp soi nổi.
Nếu được thực hiện nhiều, nấm sương mai, gỉ trắng (Albugo candida), phấn trắng và gỉ sắt có thể được xác định bằng phương pháp để ý mẫu bệnh dưới kính lúp soi nổi và kính hiển vi. Do các nấm này đều ký sinh chuyên tính, chúng không thể phát triển trên môi trường nhân tạo.
Nếu có những biểu hiện của những nấm bệnh khác (sợi nấm, bào tử hoặc những cấu trúc sinh sản), cần chuẩn bị mẫu lam kính để để ý dưới kính hiển vi. Những chi tạo bệnh đốm lá thông thường có thể xác định được bao gồm Alternaria, Cercospora, Stemphylium, Septoria và Phomopsis. Có thể thúc đẩy sự tạo thành bào tử bằng phương pháp để ẩm lá bị nhiễm bệnh trong hoàn cảnh có ánh sáng. Kiểm tra lá bệnh hằng ngày để tìm biểu hiện của nấm bệnh. (Ghi chú: nấm và vi khuẩn hoại sinh mọc nhanh trong điều kiện ẩm nên có thể dẫn tới việc chẩn đoán sai.)
Cũng rất nên cấy mô bệnh ở mép ngoài của vết đốm lá lấy từ mẫu bệnh mới thu thập lên một môi trường nghèo dinh dưỡng để phân lập nguyên nhân tạo bệnh (xem Phần 6/3).
2/ Kính lúp soi nổi và kính hiển vi
Kính lúp soi nổi và kính hiển vi là các thiết bị không thể không có được trong một phòng thí nghiệm chẩn đoán và cán bộ chẩn đoán bệnh cây cần phải làm quen với việc điều chỉnh, bảo dưỡng và dùng kính.
2/1/ Dùng kính lúp soi nổi
Kính lúp soi nổi được sử dụng để kiểm tra mẫu bệnh nhằm tìm ra những cấu trúc nấm nhỏ, như quả cành, đĩa cành, khối bào tử và quả thể với độ phóng đại thấp (tới khoảng ×100). Với kính lúp soi nổi, có thể dễ dàng lấy và chuyển các cấu trúc nấm trên sang lam kính để chuẩn bị cho việc để ý dưới kính hiển vi với độ phóng đại cao hơn (tới ×400).
Một kính lúp soi nổi cũng được dùng cho những công việc tỉ mỉ như cấy đơn bào tử nảy mầm hoặc cấy đỉnh sinh trưởng của sợi nấm trong suốt quá trình làm thuần mẫu nấm, để kiểm tra tuyến trùng và chuyển chúng sang 1 lam kính để để ý dưới kính hiển vi. Bằng phương pháp này có thể xác định xem tuyến trùng có phải là ký sinh thực vật hay không. Kính lúp soi nổi cũng cực kỳ hữu dụng trong việc kiểm tra những tản nấm đang phát triển.
Mỗi kính lúp soi nổi cần có một gương gắn vào có thể điều chỉnh độ nghiêng để có thể cung cấp ánh sáng thẳng và chéo góc cho những mẫu có độ tương phản ánh sáng thấp. Tuyệt vời nhất là kính có gắn nguồn ánh sáng sử dụng để rọi sáng bên trên bề mặt mẫu, tuy vậy nếu như không có cũng có thể giải quyết bằng phương pháp sử dụng một nguồn sáng riêng rẽ phía bên ngoài.

Kiểm tra những tản nấm dưới kính lúp soi nổi
2/2/ Dùng kính hiển vi
Cần tuân theo cẩn trọng những chỉ dẫn đi kèm theo kính hiển vi để có thể bảo đảm kính được sử dụng đúng kỹ thuật và tránh hư hại.
Điều đặc biệt là không nên để vật kính bị xước hoặc chạm vào mặt thạch, nấm hoặc những mẫu nhuộm. Những miếng lamen thường cực kỳ mỏng và, nếu vỡ, có khả năng làm đứt tay.
Điều chỉnh kính hiển vi
1/ Đặt một lam kính có chứa mẫu trên bàn giữ của kính hiển vi.
2/ Bật đèn và điều chỉnh ánh sáng đến khoảng 50% độ sáng.
3/ Chỉnh mẫu thật nét với vật kính ×10/
4/ Đóng màng ngăn quang trường của kính cho nhỏ lại.
5/ Chỉnh độ nét màng ngăn quang trường bằng phương pháp thay đổi độ cao của tụ kính.
6/ Xoay hai nút chỉnh trung tâm tụ sáng cho đến lúc ảnh của màng ngăn quang trường ở trung tâm – chi tiết này cực kì quan trọng!
7/ Mở màng ngăn quang trường cho đến lúc vừa ra khỏi tầm nhìn (nghĩa là cho đến lúc vừa lớn hơn khung nhìn một chút).
8/ Chỉnh màng chỉnh độ mở để nhìn thấy rõ mẫu. Số chỉnh (số độ mở) trên màng chỉnh độ mở nên vào khoảng 75% của số độ mở vật kính đang dùng.
9/ Để ý mẫu.
2/3 Chuẩn bị mẫu lam kính
Những mẫu bào tử nấm hoặc cấu trúc tạo bào tử như túi quả cành, quả thể bầu hoặc quả thể kín có thể được cố định trên lam kính trong nước.
Cố định mẫu trong nước
1/ Nhỏ một giọt nước cất nhỏ lên lam kính.
2/ Đặt mẫu vào vị trí giọt nước, dưới một kính lúp soi nổi.
3/ Đặt lamen sao cho một cạnh chạm lam kính gần mép giọt nước.
4/ Dần dần hạ cạnh bên kia của lamen xuống sao cho lamen trùm lên phía trên giọt nước – biện pháp này giúp đẩy những bọt khí ra khỏi mẫu lam.
5/ Sử dụng một miếng giấy thấm hoặc giấy lọc để thấm đi phần nước thừa phía ngoài lamen.
Những bào tử từ cây bị hại hoặc mẫu nấm được nuôi cấy nhân tạo có thể được kéo ra sử dụng một que cấy và đặt vào vị trí giọt nước.
Những cấu trúc tạo bào tử lớn hơn cần phải được kiểm tra dưới kính lúp soi nổi, tiếp đến được đặt vào một giọt nước và làm dẹp bằng phương pháp sử dụng một vật dụng có mặt phẳng ép nhẹ lên lamen. Khi kiểm tra lại bằng mẫu lam, có thể phân biệt được quả cành và quả thể: quả cành chỉ có chứa bào tử phân sinh trong khi cả quả thể kín và quả thể bầu có chứa cả túi bào tử và bào tử túi.

Để ý bào tử nấm dưới kính hiển vi

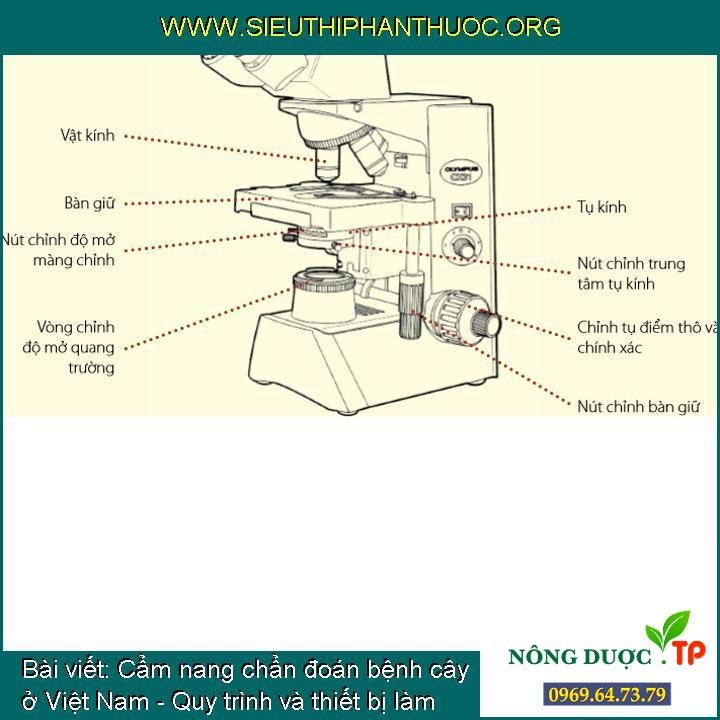
Những bộ phận của kính hiển vi
Những cấu trúc với mô mềm, như quả thể đĩa của Sclerotinia sclerotiorum, cần sử dụng lưỡi dao cạo ướt hoặc dao mổ cắt thành các lát mỏng rồi đặt vào vị trí giọt nước để làm mẫu lam.
3/ Phân lập nấm tạo bệnh
Không cần thiết phải tuân theo 1 cách chuẩn xác các kỹ thuật phân lập nấm gây thối rễ, thân và lá sau đây, mà có thể dùng các kỹ thuật này làm định hướng và thay đổi chúng dựa theo từng nguyên nhân tạo bệnh và cây trồng cụ thể sao cho có kết quả tối ưu nhất. Điều đặc biệt là học hỏi và tích lũy kinh nghiệm bằng phương pháp thử nghiệm những biện pháp khác nhau.
Cán bộ làm công tác chẩn đoán bệnh cây nên tham gia những khóa tập huấn về những kỹ năng trong khu vực phòng thí nghiệm nếu họ chưa từng được tập huấn về những kỹ năng này trước đây. Điều đặc biệt là học phương pháp phân biệt giữa những loài tạo bệnh và với những loài hoại sinh thông thường.
Thực hiện quy trình phân lập và cấy truyền với một loạt những nấm bệnh khác nhau.
Những kỹ thuật phân lập có thể được nâng cấp bằng phương pháp:
- Thay đổi thời gian tiệt trùng bề mặt mẫu bệnh
- Gọt bỏ lớp bên ngoài mẫu bệnh
- Điều chỉnh thành phần môi trường nuôi cấy (ví dụ như pH, dinh dưỡng và nồng độ aga)
- Thêm kháng sinh vào môi trường.
Cồn êtyl (70%) là chất tiệt trùng bề mặt chuẩn cho những vật dụng phòng thí nghiệm và những mẫu bệnh. Dung dịch Javen cũng có thể được sử dụng làm chất tiệt trùng bề mặt, nhưng thường mất công dụng nếu để lâu và tiếp xúc trực tiếp với ánh sáng.
Thường xuyên thấm khô mô bệnh trên giấy thấm đã được tiệt trùng trước khi phân lập.

Chọn mô mới bị nhiễm bệnh để phân lập. Hạn chế dùng những mô đã bị nhiễm bệnh lâu chính vì trên bề mặt những mô bệnh này thường có cực kỳ nhiều nấm và vi khuẩn hoại sinh phát triển.
Bề mặt của mô cây thông thường có rất nhiều nấm và vi khuẩn hoại sinh, chúng cần được diệt trừ trước khi có thể phân lập nguyên nhân tạo bệnh. Nhiều loại nấm và vi khuẩn hoại sinh mọc cực kỳ nhanh trên môi trường phân lập, do đó cực khó để phân lập nguyên nhân tạo bệnh.
Không sử dụng môi trường thạch đường khoai tây (PDA) hoặc môi trường giầu hydrat cacbon để phân lập nấm từ những mô cây bị hại, nhất là nếu phân lập từ rễ. Nấm và vi khuẩn hoại sinh mọc cực kỳ nhanh trên những môi trường giầu hydrat cacbon và ức chế sự phát triển của nấm bệnh mọc chậm hơn.
Sự thành công trong việc phân lập nấm từ mô cây bị hại dựa vào một vài nhân tố:
• loại mô bị nhiễm bệnh (lá, thân, rễ)
• biện pháp tiệt trùng bề mặt
• thao tác cấy
• môi trường phân lập
• những điều kiện nuôi những đĩa phân lập.
 Kinh nghiệm quá khứ là một công cụ vô giá trong việc chọn lựa quy trình phân lập thích hợp. Kinh nghiệm thường giúp phán đoán loại nấm tạo bệnh nào có thể gây nên những dấu hiệu đặc biệt nào đó. Khi còn nghi ngờ, nên lấy thông tin từ những cơ sở dữ liệu bằng hình ảnh, sổ lưu thông tin mẫu bệnh và những tài liệu đã phát hành.
Kinh nghiệm quá khứ là một công cụ vô giá trong việc chọn lựa quy trình phân lập thích hợp. Kinh nghiệm thường giúp phán đoán loại nấm tạo bệnh nào có thể gây nên những dấu hiệu đặc biệt nào đó. Khi còn nghi ngờ, nên lấy thông tin từ những cơ sở dữ liệu bằng hình ảnh, sổ lưu thông tin mẫu bệnh và những tài liệu đã phát hành.
3/1/ Phân lập từ lá và thân
Việc phân lập từ thân thường hay được nâng cấp bằng phương pháp gọt bỏ phần vỏ hoặc những mô thân phía bên ngoài trước khi tiệt trùng bề mặt.
Những bước cơ bản phân lập từ lá hoặc thân
1/ Lau sạch bàn làm việc bằng cồn êtyl 70%
2/ Nhúng vật dụng (kẹp và dao hoặc dao mổ) trong cồn êtyl 70% và hơ khô trên ngọn lửa. (Cồn mêtyl có thể được sử dụng thay cho cồn êtyl.)
3/ Rửa mẫu lá hoặc thân trong nước để tiến hành loại bỏ đất bụi và những tạp chất khác.
4/ Tiệt trùng bề mặt mô lá hoặc thân bằng phương pháp sử dụng giấy mềm (giấy ăn) đã nhúng cồn êtyl 70% lau mặt lá hoặc bằng phương pháp nhúng nhanh lá dầy vào cồn êtyl 70% trong 5 giây, rửa lại trong nước vô trùng và để khô trên giấy thấm vô trùng.
5/ Sử dụng vật dụng đã tiệt trùng cắt các miếng cấy nhỏ (khoảng 2 × 2 mm) từ phần ranh giới giữa mô khỏe và mô bệnh, tiếp đến cấy lên môi trường nghèo dinh dưỡng (như thạch nước cất [WA]) hoặc môi trường lựa chọn, đặt các miếng cấy gần mép đĩa.
6/ Đặt đĩa cấy ở nhiệt độ khoảng 25oC, tuyệt vời là trong hoàn cảnh ánh sáng.
7/ Kiểm tra đĩa cấy hằng ngày, khi những tản nấm sinh trưởng từ các miếng cây, cấy truyền chúng (lưu ý cắt ở mép ngoài tản nấm) sang môi trường như PDA hoặc WA chứa những miếng mô cây đã tiệt trùng, ví dụ như cọng lúa còn xanh, lá cẩm chướng hoặc quả đậu. (Những miếng mô cây đã được tiệt trùng thúc đẩy sự tạo thành bào tử, hỗ trợ cho việc giám định nguyên nhân tạo bệnh.)
8/ Giám định lần cuối sử dụng mẫu cấy đã được làm thuần từ một bào tử nảy mầm hoặc đỉnh sinh trưởng của sợi nấm. (Những thao tác này được miêu tả trong Phần 6/5/1 và 6/5/2/)
Môi trường sử dụng để phân lập phụ thuộc vào loại nấm được nghi là nguyên nhân tạo bệnh. Môi trường thạch nước cất hoặc PDA một phần tư độ mạnh, có chứa kháng sinh nếu cần, là các môi trường phân lập phổ biến nhất. Có thể dùng môi trường phân lập lựa chọn như peptone pentachloronitrobenzene agar (PPA) cho Fusarium spp. và môi trường lựa chọn nbsp;Phytophthora (PSM) cho Phytophthora spp.
Những nấm hoại sinh, như Alternaria, Pestalotia và Cladosporium, thường phát triển trên những mô lá chết. Sự hiện diện của các nấm này có thể gây khó khăn cho việc phân lập những loài Alternaria hoặc nấm lá khác tạo bệnh, như Stemphylium và Bipolaris.
Biện pháp khác để phân lập nấm tạo bệnh đốm lá
1/ Đặt cả lá hoặc một mảnh lá trên giấy ẩm trong đĩa Petri ở môi trường để ẩm.
2/ Đặt mẫu lá ở nhiệt độ khoảng 25oC dưới ánh sáng để thúc đẩy việc tạo bào tử.
3/ Đánh giá sau 1-2 ngày dưới kính lúp soi nổi để tìm bào tử hoặc những cấu trúc tạo bào tử như quả cành, đĩa cành hoặc khối bào tử.
4/ Thêm vào môi trường phân lập có chứa WA một giọt axít lactic (gây giảm pH và hạn chế sự phát triển của vi khuẩn) hoặc kháng sinh (như trong môi trường PPA).
5/ Sử dụng một que cấy vô trùng cấy chuyển bào tử vào đĩa.
3/2/ Phân lập từ rễ mảnh, nhỏ
Các rễ con mảnh, nhỏ, và các rễ phụ làm nhiệm vụ hấp thu dinh dưỡng cho sự phát triển của cây và quan trọng cho sức khỏe của cây. Những nguyên nhân tạo bệnh như Rhizoctonia, Pythium, Phytophthora và Phoma thường tạo bệnh ở các bộ phận này.
Nhiều nấm (như một vài nbsp;Fusarium spp. và Trichoderma spp.) và vi khuẩn hoại sinh thường thâm nhập vào những tế bào ngoài của vỏ rễ. Do đó, việc phân lập nguyên nhân tạo bệnh từ rễ con có thể gặp khó khăn.
Không tiệt trùng bề mặt các rễ con quá mức chính vì chất tiệt trùng có thể diệt trừ toàn bộ những nấm ký sinh trong rễ con, kể cả nấm tạo bệnh.
Phân lập từ rễ mảnh, nhỏ
1/ Chọn các rễ con có cả phần khỏe (không dấu hiệu ) và phần bị nhiễm bệnh, rửa chúng bằng nước vô trùng đựng trong lọ nhỏ, thay nước 3 lần. Thêm một giọt thuốc tẩy vào lọ trong lượt rửa giai đoạn đầu.
2/ Lau chùi bàn làm việc bằng cồn êtyl 70%.
3/ Nhúng vật dụng (kẹp và dao hoặc dao mổ) trong cồn êtyl 70% và hơ khô trên ngọn lửa. (Cồn mêtyl có thể thay thế cho cồn êtyl)
4/ Nhúng qua các rễ con trong cồn êtyl 70%, rửa nhanh trong nước vô trùng và để khô trên giấy thấm đã tiệt trùng. Cách khác, tiệt trùng bề mặt rễ con bằng dung dịch Javen 1% trong cồn êtyl 10% chỉ trong khoảng 10-15 giây, tiếp đến rửa bằng nước vô trùng ngay lập tức và để khô trên giấy thấm vô trùng trong tủ cấy vô trùng.
5/ Sử dụng vật dụng đã tiệt trùng cắt rễ thành từng miếng dài 1-2 mm ở phần ranh giới giữa mô khỏe và mô bệnh tiếp đến cấy lên WA hoặc môi trường lựa chọn.
6/ Ấn nhẹ những miếng cấy lên mặt thạch sao cho chúng tiếp xúc tốt với kháng sinh trong môi trường phân lập.
7/ Đặt đĩa cấy ở nhiệt độ khoảng 25oC và để ý hằng ngày dưới kính lúp soi nổi để kiểm tra nấm mọc từ những miếng rễ cấy.
8/ Cấy truyền từng tản nấm lên môi trường PDA hoặc WA chứa những miếng mô cây đã tiệt trùng, như những mẩu thân lúa còn xanh.
9/ Làm thuần nấm bằng phương pháp cấy đỉnh sinh trưởng của sợi nấm (xem Phần 6/5/1) hoặc cấy đơn bào tử nảy mầm (xem Phần 6/5/2) trước khi giám định lần cuối cùng.
Cần lưu ý là việc phân lập một vài nấm hoại sinh cùng một lúc với nấm bệnh từ mô rễ bị nhiễm bệnh là thường hay xẩy ra. Với kinh nghiệm, chỉ bằng để ý có thể nhận ra một vài nấm bệnh trên môi trường PDA. Phải triển khai truyền bệnh nhân tạo trước khi cam kết nguyên do tạo bệnh.
3/3/ Phân lập từ rễ và thân gỗ
Nấm tạo bệnh ở rễ thường phải được phân lập từ rễ chính hoặc gốc thân của cây thân gỗ. Nói chung phân lập từ mô thân dễ thành công hơn. Thường thì có ít vi sinh vật hoại sinh ở phần gốc thân hơn là phần rễ đã hóa gỗ.
Việc lựa chọn biện pháp tiệt trùng phụ thuộc vào cấp độ hóa gỗ của mô. Tiệt trùng bề mặt những phần thân mềm hơn có thể chỉ giản đơn bằng phương pháp lau hoặc xịt cồn êthanol 70% trước khi cấy lên môi trường nhân tạo.
Phân lập từ rễ và thân gỗ
1/ Cắt bỏ các rễ phụ.
2/ Rửa mẫu trong nước với một chút nước tẩy rửa để tiến hành loại bỏ đất và những tạp chất khác.
3/ Gọt bỏ lớp bên ngoài của thân hoặc rễ vì đây thường là nơi có chứa những vi sinh vật hoại sinh.
4/ Bỏ đi phần dưới của thân nơi tiếp giáp với mặt đất. Việc chọn lựa mô để phân lập dựa vào mức độ bệnh gây hại. Không cố phân lập từ những mô bệnh đã cũ. Tuyệt vời nhất là sử dụng những mẩu mô cấy lấy từ ranh giới giữa mô khỏe và mô bệnh.
5/ Phun xịt mẫu bằng cồn 70%.
6/ Hơ qua lửa để đốt bớt lượng cồn thừa, hoặc nếu thân mềm thì để cho cồn tự bay hơi.
7/ Cắt các miếng mô thân mỏng và cấy lên môi trường nghèo dinh dưỡng hoặc môi trường lựa chọn.
3/4/ Bẫy đất
Bẫy đất là một biện pháp gián tiếp để phân lập những loài Phytophthora và Pythium từ đất hoặc rễ.
Bẫy nấm từ đất bằng táo hoặc những quả khác
1/ Lau táo với cồn.
2/ Sử dụng một cái khoan nút chai sạch cắt một lỗ có đường kính khoảng 10 mm từ một bên tới lõi.
3/ Bỏ đất đầy lỗ và dán lỗ bằng một miếng băng dính để đất khỏi rơi ra ngoài.
4/ Đặt táo ở nhiệt độ phòng có ánh sáng.
5/ Phân lập nấm sau 1-3 ngày từ phần ranh giới giữa mô khỏe và mô bệnh màu nâu lan ra từ phần đất bẫy.
Biện pháp này không phải là hoàn toàn lựa chọn chính vì nhóm nấm tiếp hợp mọc nhanh cũng có thể gây những vết thương tương đương.
Bẫy từ dung dịch đất bằng lá và cánh hoa
Những loài Phytophthora và Pythium có thể được phân lập từ đất bằng phương pháp thả nổi lá hoặc cánh hoa hồng sạch trên dung dịch đất bẫy. Nếu có những loài này trong đất, du động bào tử được tạo thành dịch chuyển lên bên trên và xâm nhập và lây nhiễm vào lá hoặc cánh hoa. Đây chính là biện pháp lựa chọn chính vì nó phù hợp cho việc phân lập những loài sản tạo ra du động bào tử.
1/ Cho khoảng 100g đất vào một cốc nhựa.
2/ Đổ nước vô trùng hoặc nước cất vào cốc sao cho ngập đất khoảng 5-10 centimét.

Kỹ thuật phân lập nguyên nhân tạo bệnh từ những mô hóa gỗ: (a) cắt rời rễ phụ, (b) rửa mẫu, (c) cắt bỏ phần dưới thân ở chỗ tiếp giáp với mặt đất, (d) phun xịt mẫu với cồn 70%, (e) để cồn bay hơi, (f ) cắt mô thân cây bị bệnh thành từng miếng cấy nhỏ
3/ Thả vào cốc các mẩu bộ phận tươi của cây trồng mẫn cảm với bệnh, những nguyên vật liệu bẫy này sẽ nổi phía trên mặt nước.
4/ Đặt cốc nguyên vị trí trong vòng 2-4 ngày.
5/ Phân lập nấm sau 2-3 ngày từ mép vết bệnh đã phát triển trên nguyên vật liệu bẫy sau khi rửa trong nước vô trùng và tiệt trùng bề mặt, sử dụng môi trường lựa chọn (như PSM).
Nguyên vật liệu bẫy cũng có thể là nhiều loại cây trồng ký chủ của Phytophthora hoặc Pythium. Nguyên vật liệu có thể sủ dụng để bẫy bao gồm lá ớt, cánh hoa hồng, lá cây có múi, cây giống ớt, đậu lupin và đậu nành. Nếu bẫy không tự nổi được, có thể treo bẫy lên nắp cốc sao cho bẫy lơ lửng ở mặt nước hoặc gắn vào một miếng xốp hay một nguyên vật liệu nổi phù hợp.
Phân lập từ rễ con sử dụng cây ký chủ làm bẫy
1/ Rửa rễ con bị nhiễm bệnh.
2/ Đặt rễ con vào một cốc nhựa và đổ nước vô trùng hoặc nước cất vào cốc.
3/ Thả nổi một lá cây ký chủ vào cốc.
4/ Để cốc nguyên vị trí trong 2-4 ngày.
5/ Phân lập nấm sau 2-3 ngày từ mép ngoài của vết bệnh đã phát triển trên lá bẫy sau khi rửa bằng nước vô trùng và tiệt trùng bề mặt, sử dụng môi trường lựa chọn (như PSM).
3/5/ Biện pháp pha loãng dung dịch đất
Biện pháp pha loãng dung dịch đất được dùng để phân lập những loài Fusarium từ đất khô bằng môi trường lựa chọn PPA. Biện pháp này có thể được ứng dụng để phân lập một vài loài nấm khác dùng những môi trường lựa chọn phù hợp.

Bẫy Phytophthora từ đất bằng cánh hoa và lá
Phân lập từ đất khô bằng cách pha loãng dung dịch đất
1/ Phơi mẫu đất cho khô, sử dụng cối chày nghiền sơ đất (loại cối chày làm bằng đá sử dụng trong nấu bếp) và trộn đều.
2/ Cho 10g mẫu đất vào một lọ chứa 100 mililít WA 0.01% đã hấp khử trùng, tạo dung dịch 1:10/
3/ Đổ 10 mililít dung dịch sang lọ thứ hai có chứa 90 mililít WA 0.01% tạo dung dịch 1:100 và lắc đều để có thể bảo đảm đất được phân tán đều trong dung dịch. Lặp lại đoạn này để có dung dịch với nồng độ 1:1000, thông thường độ loãng này là thích hợp cho việc phân lập Fusarium từ đất trồng rau màu.
4/ Phân tán đều 1 mililít dung dịch đất trên bề mặt môi trường phân lập trong một đĩa Petri đường kính 90mm:
- Chuẩn bị những đĩa môi trường phân lập và để khô trong vài ngày để tiến hành loại bỏ hơi nước đọng trên bề mặt đĩa
- Sử dụng pipette cẩn trọng hút 1 mililít dung dịch đất cho vào một phía ở rìa của đĩa môi trường
- Cầm đĩa hơi nghiêng từ mép có dung dịch và lắc nhẹ vuông góc với chiều dốc để dung dịch ướt đều trên bề mặt đĩa.
5/ Đặt những đĩa phân lập này dưới ánh sáng trong 5-7 ngày cho đến lúc những tản nấm sinh trưởng.
6/ Cấy truyền những tản nấm và làm thuần chúng bằng cách cấy đơn bào tử lên môi trường PDA, thạch lá cẩm chướng (CLA), hoặc thạch nước cất chứa một mẩu mô cây đã tiệt trùng.
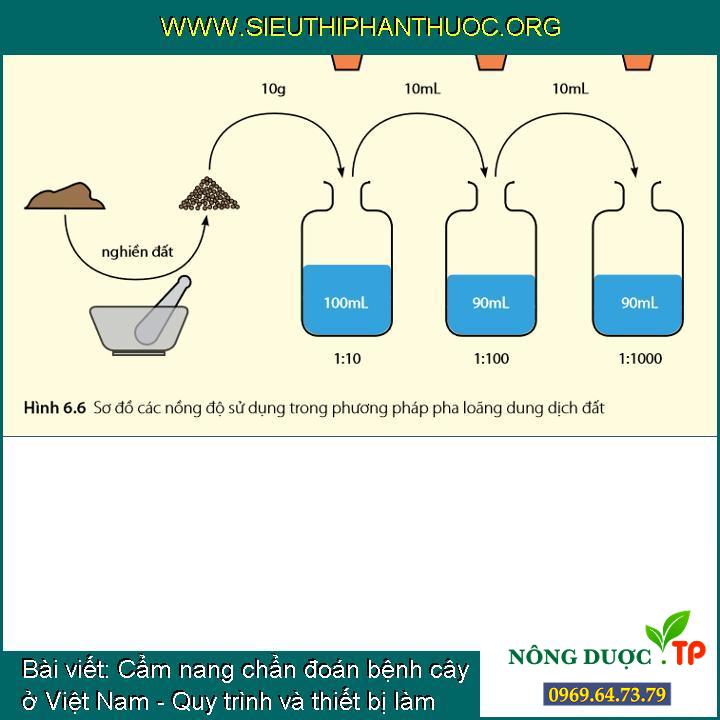
Sơ đồ những nồng độ dùng trong biện pháp pha loãng dung dịch đất
Cho dù nồng độ pha loãng 1:1000 thường hay được dùng, độ loãng phù hợp nên dùng khi cho kết quả 10-30 tản nấm trên mỗi đĩa. Vì mật độ Fusarium trong đất phụ thuộc vào lịch sử ruộng trồng và loại đất, có thể cần phải điều chỉnh nồng độ pha loãng để có thể có được một kết quả có nhu cầu.
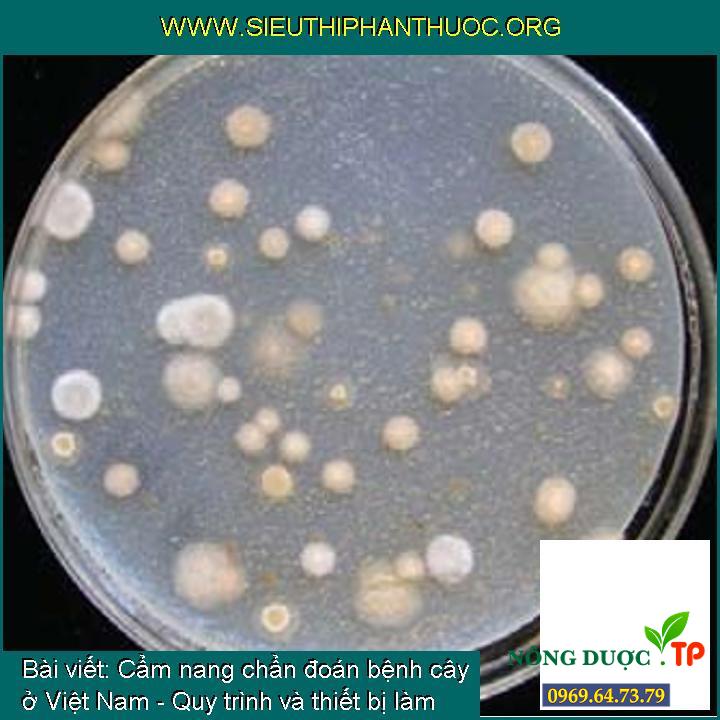
Đĩa phân lập từ dung dịch đất pha loãng có chứa nbsp;Fusarium spp. Ở trên môi trường thạch peptôn PCNB (tuyệt vời là số tản nấm khoảng từ 10 đến 30)
Nếu quy trình phân lập được thiết kế để có thể cung cấp số liệu định lượng, sử dụng 3-5 đĩa nhắc lại cho mỗi nồng độ và dùng vài mẫu đất. Có thể có sự khác nhau đáng kể giữa những đĩa nhắc lại và giữa những mẫu đất.
Biện pháp này không xác định được số lượng bào tử trong đất, mà là lượng ‘mầm bệnh’ của một loài trong đất. Những mầm bệnh có thể gồm bào tử phân sinh, bào tử hậu và những mảnh sợi nấm trong tàn dư các loại thực vật bị nhiễm bệnh. Số lượng các đơn vị tạo tản nấm (colony-forming units – CFU) này trong từng gram đất có thể được tính cho mỗi loài sử dụng công thức sau:
| Độ loãng × số tản nấm trung bình của loài nấm trên những đĩa phân lập = CFU/g đất |
4/ Cấy truyền từ những đĩa phân lập
Cấy truyền là bước trung gian giữa phân lập từ mẫu bệnh và làm thuần vi sinh vật tạo bệnh. Thời kỳ này giúp xác định vi sinh vật nào đã được phân lập.
Quy trình cấy truyền
1/ Kiểm tra những đĩa cấy hằng ngày dưới kính lúp soi nổi và nhận xét sự phát triển của sợi nấm từ những miếng cấy.
2/ Xác định xem có rất nhiều hơn một loài nấm mọc lên hay không.
3/ Cấy truyền khi sợi nấm mọc được khoảng 5mm từ miếng cấy.
4/ Cắt một miếng thạch nhỏ (2 × 2 mm) từ rìa mỗi tản nấm và cấy sang môi trường PDA hoặc một môi trường chứa giá thể tự nhiên (như môi trường CLA hoặc môi trường thạch thân lúa còn xanh).
Có một vài bệnh nấm mà nguyên nhân tạo bệnh được phân lập 1 cách đơn giản và những vi sinh vật hoại sinh hiếm khi cản trở việc phân lập. Ví dụ như nbsp;Sclerotinia sclerotiorum và Sclerotium rolfsii có thể được phân lập dễ dàng từ ranh giới giữa mô khỏe và mô bệnh ở thân bệnh còn xanh.
Việc phân lập từ những bộ phận khác của cây có khả năng khó khăn hơn. Khi phân lập từ rễ bị nhiễm bệnh, thông thường có khoảng hai loại nấm hoặc nhiều hơn mọc từ rễ, thậm chí ngay cả trên môi trường lựa chọn. Vấn đề tương đương có thể xẩy ra khi tìm cách phân lập nấm bệnh từ vết đốm lá, chính vì nấm hoại sinh mọc nhanh trên những mô lá bị nhiễm bệnh. Cần lưu ý cấy truyền khi những tản nấm còn nhỏ vì cấy truyền được thực thi dễ hơn trước khi những loài mọc nhanh mọc lấn át những loài mọc chậm.
Do đó, cần phải tiến hành kiểm tra những đĩa phân lập hằng ngày để tìm nấm mọc. Để ý những miếng cấy xem có tình trạng tạo thành bào tử không, đây có thể là biểu hiện nhận ra nguyên nhân tạo bệnh. Tuy vậy, nên chú ý rằng bào tử tạo thành có thể kéo dài từ nấm hoại sinh.

Thực hiện nhiều sẽ dẫn tới sự thành công! Thực hiện phân lập ở trên nhiều loại nấm bệnh khác nhau để lấy kinh nghiệm và để học phương pháp nhận biết sự phát triển của những nấm tạo bệnh thông dụng trên những đĩa phân lập.
Những nấm hoại sinh thường hay xuất hiện trong mô bệnh và thường phát triển trên đĩa cấy phân lập. Một vài, như Trichoderma, cản trở quá trình phân lập. Những nấm hoại sinh lây lan qua không khí, như Penicillium và Cladosporium cũng có thể gây nhiễm những đĩa cấy.
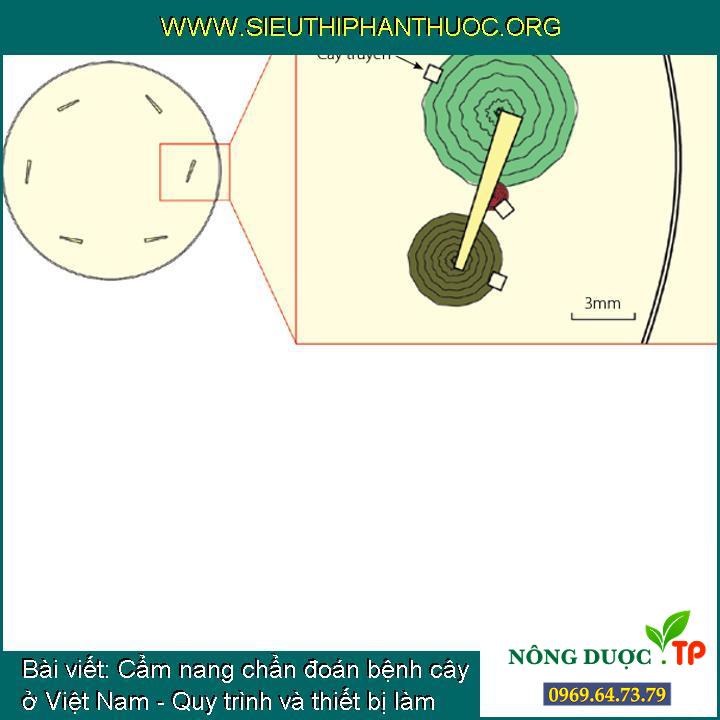
Sơ đồ một đĩa phân lập từ rễ cho biết (hình trong) nhiều loại nấm mọc ra từ cùng một đoạn rễ
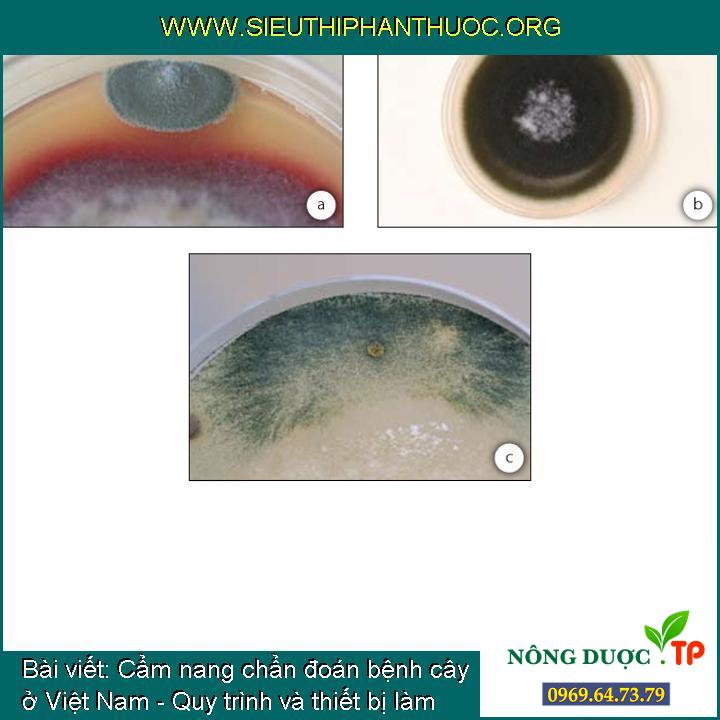
Các nấm tạp thường được thấy trên những đĩa cấy: (a) Penicillium sp. (gây tạp từ không khí), (b) Cladosporium sp. (trong mẫu cấy sạch), (c) Trichoderma sp. (mọc từ một mẩu rễ bị nhiễm bệnh )
Một khi những mẫu cấy truyền phát triển thành những tản nấm, chúng có thể được nhóm lại theo hình thức biểu hiện ra bên ngoài tản nấm và những đặc điểm hình thức biểu hiện ra bên ngoài khác cho việc giám định lúc đầu. Những nấm hoại sinh phổ biến có thể được xác định, loại bỏ và những nấm có thể là nguyên nhân tạo bệnh có thể được làm thuần bằng cách cấy đỉnh sinh trưởng sợi nấm hoặc cấy đơn bào tử sang 1 môi trường phù hợp để giám định sau này.
5/ Làm thuần mẫu nấm
Thời kỳ cuối cùng trong việc giám định nấm tạo bệnh là việc làm thuần mẫu nấm. Chỉ có một bào tử hoặc một đỉnh sinh trưởng của sợi nấm được cấy sang môi trường sạch để có thể bảo đảm nấm được cấy là hoàn toàn thuần.
5/1/ Cấy đơn bào tử
Cấy đơn bào tử là quá trình cấy truyền một bào tử đã nảy mầm để tạo một mẫu nấm thuần. Biện pháp này phù hợp cho việc làm thuần các chi nấm tạo bào tử trên môi trường nhân tạo, như Fusarium, Colletotrichum, Alternaria, Stemphylium, Bipolaris, Verticillium và Phoma.
Cấy đơn bào tử
1/ Tiệt trùng que cấy.
2 & 3/ Tạo dung dịch bào tử bằng phương pháp sử dụng que cấy lấy một lượng nhỏ sợi nấm phía trên mặt thạch có lẫn bào tử hoặc lấy một chút bào dần dần khối bào tử lớn của Fusarium spp. rồi cho vào ống nghiệm có chứa 10 mililít nước vô trùng.
4/ Lắc ống nghiệm để phân tán những bào tử và kiểm tra mật độ bào tử bằng phương pháp để ý ống nghiệm trước ánh sáng hoặc kiểm tra một giọt dịch bào tử dưới kính lúp soi nổi. Tránh tạo dịch bào tử với mật độ bào tử quá cao. Bằng kinh nghiệm, mật độ bào tử có thể được nhận xét bằng mắt thường khi nhìn ống nghiệm.
5/ Làm loãng với nước vô trùng nếu cần.
6/ Đổ dịch bào tử vào một đĩa Petri chứa một lớp mỏng môi trường thạch nước cất.
7/ Đổ dịch bào tử thừa từ đĩa Petri đi. Một vài bào tử sẽ nằm lại phía trên mặt thạch.
8/ Để dựng đĩa Petri trong khoảng 18 giờ cho đến lúc bào tử nảy mầm.
9/ Kiểm tra đĩa Petri dưới kính lúp soi nổi với nguồn sáng bên dưới. (Điều chỉnh gương trên nguồn sáng cẩn trọng để có sự tương phản tốt giữa thạch, bào tử, và những ống mầm.)
10/ Sử dụng một que cấy dẹp cắt kéo ra một bào tử nảy mầm và chuyển sang 1 đĩa môi trường mới (Phụ lục 1 miêu tả kỹ thuật làm một que cấy dẹp).
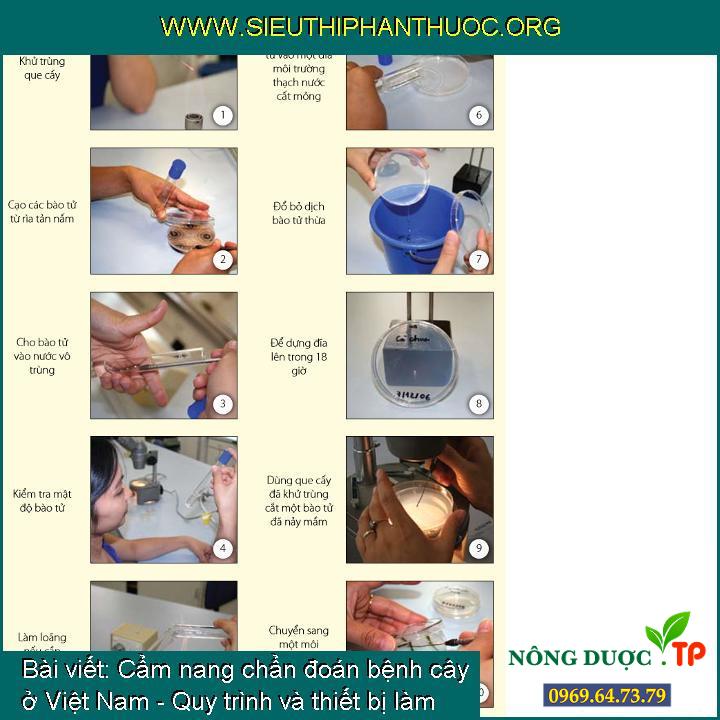
Những bước cấy đơn bào tử
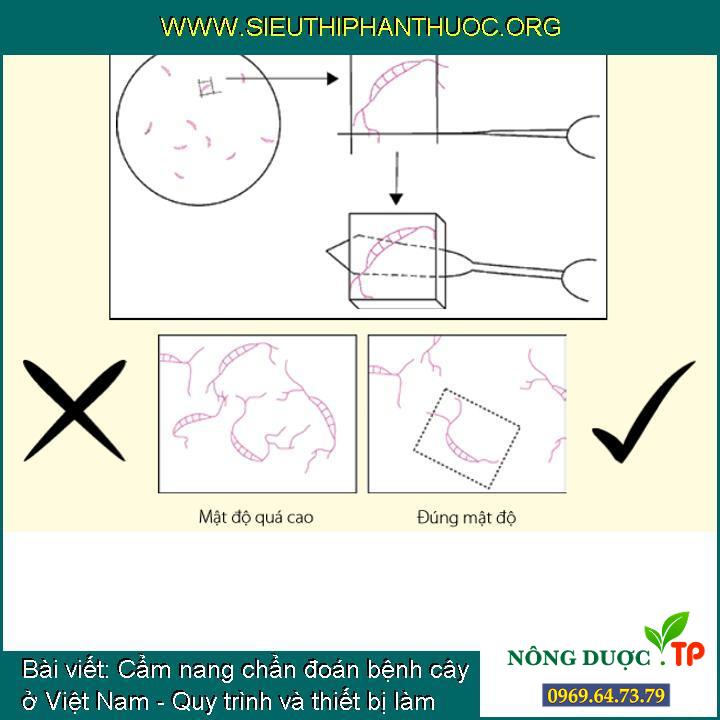
Quy trình cấy đơn bào tử, thao tác lựa chọn một bào tử đúng kỹ thuật
5/2/ Cấy đỉnh sinh trưởng sợi nấm
Cấy đỉnh sinh trưởng sợi nấm là quá trình cấy truyền đỉnh sinh trưởng của một sợi nấm để tạo một mẫu nấm thuần. Biện pháp này phù hợp cho việc làm thuần những chi nấm như Phytophthora, Pythium, Rhizoctonia, Sclerotium và Sclerotinia.
Cấy đỉnh sinh trưởng sợi nấm
1/ Đổ môi trường thạch nước cất vào đĩa Petri để nghiêng sao cho phần thạch ở một phía của đĩa nông.
2/ Cấy truyền một miếng nhỏ nấm từ đĩa phân lập vào một bên đĩa nơi thạch sâu hơn.
3/ Đặt đĩa dưới kính lúp soi nổi và điều chỉnh tiêu điểm sợi nấm ở rìa tản nấm. (Những sợi nấm sẽ mọc cực kỳ thưa ở phần nông của thạch)
4/ Điều chỉnh nguồn sáng (gương) nhằm đạt độ tương phản tốt giữa môi trường và sợi nấm.
5/ Sử dụng que cấy dẹp đã tiệt trùng cấy một miếng thạch nhỏ có chứa đỉnh sinh trưởng của một sợi nấm sang 1 đĩa môi trường phù hợp.
Chỉ cấy phần đỉnh của một sợi nấm độc nhất để có thể bảo đảm mẫu nấm được làm thuần hoàn toàn.

Cấy đỉnh sinh trưởng sợi nấm, ví dụ đầu của một sợi nấm Rhizoctonia sp. được lấy từ đĩa môi trường thạch nghiêng.
6/ Nhận biết những mẫu nấm thuần
Có thể có sự khác nhau đáng kể trong hình thức biểu hiện ra bên ngoài và màu sắc những tản nấm của cùng một loài. Việc chẩn đoán trở thành dễ hơn khi những cán bộ chẩn đoán học phương pháp nhận biết tản nấm của những loài nấm thông thường trên môi trường nhân tạo. Những mẫu nấm tiếp đến có thể được phân loại dễ dàng thành nhóm những loài nấm bệnh và những loài nấm hoại sinh bằng mắt thường. Thao tác này có khả năng làm hạ bớt số lượng mẫu nấm cần làm thuần, tiết kiệm kinh phí và thời gian.

Tản nấm của một vài nấm bệnh thông dụng trên môi trường thạch đường khoai tây
Việc giám định cuối cùng những mẫu sạch cần dựa trên:
- Những đặc điểm vi hình thức biểu hiện ra bên ngoài (như quả thể vô tính và hữu tính)
- Hình thức biểu hiện ra bên ngoài bào tử hoặc hình thức biểu hiện ra bên ngoài hạch nấm
- Hình thức tạo bào tử (như bản chất của tế bào sinh bào tử và sự hình thành hay không hình thành chuỗi bào tử).
Một vài nấm tạo bệnh quan trọng không tạo bào tử và chỉ có thể nhận biết qua sự hiện diện và hình thức biểu hiện ra bên ngoài của hạch nấm (như Sclerotinia spp., Sclerotium spp. và một vài loài Rhizoctonia). Nếu như không có sự tạo thành những quả thể vô tính hoặc hữu tính, hay những bào tử hoặc hạch nấm thì chuyện giám định đến loài có thể gặp khó khăn.
7/ Giám định nấm tạo bệnh
Có hơn 10/000 loài nấm và những loài giống nấm tạo bệnh cây. Các vi sinh vật này là nguyên nhân gây nên cực kỳ nhiều những bệnh, bao gồm đốm và cháy lá, thối thân, loét, thối rễ, héo và chết mòn, những bệnh ở cây giống, quả, thối nõn và hạt, u sưng, gỉ sắt, than đen và sương mai.
Việc giám định chuẩn xác một nguyên nhân tạo bệnh là bước đầu then chốt trong việc xây dựng những giải pháp ngăn ngừa, diệt trừ và quản lý bệnh gây hại tổng hợp. Nếu xác định được tên nguyên nhân tạo bệnh, thì có thể tìm thông tin về đặc điểm sinh học, dịch tễ học và những giải pháp ngăn ngừa, diệt trừ qua những tài liệu đã xuất bản hoặc qua mạng internet.
Việc giám định chuẩn xác nguyên nhân tạo bệnh là cực kỳ cấp thiết cho việc chọn lựa đúng thuốc trừ nấm trong trường hợp ngăn ngừa, diệt trừ bằng giải pháp hóa học. Chẳng hạn, một số loại thuốc trừ nấm có thể ngăn ngừa, diệt trừ bệnh sương mai thì không có hiệu quả đối với bệnh phấn trắng.
Việc giám định nguyên nhân nấm tạo bệnh bắt đầu bằng việc dựa trên những đặc điểm hình thức biểu hiện ra bên ngoài, như bào tử và những cấu trúc tạo bào tử. Nói chung, cần để ý dưới kính hiển vi (xem Phần 6/2) để có thể nhận ra nguyên nhân tạo bệnh và chẩn đoán bệnh. Việc giám định hình thức biểu hiện ra bên ngoài được trợ giúp nhờ những khóa phân loại, tài liệu chia sẻ cách, và cũng có rất nhiều hình ảnh minh họa cực kỳ hữu dụng cho các loại nấm bệnh thông dụng trong Agrios (2005). Nên lưu giữ một vài sách và cẩm nang khác làm tài liệu tham khảo trong những phòng thí nghiệm chẩn đoán, và may mắn là nhiều tạp chí khoa học về phân loại và giám định có thể được tiếp cận qua mạng internet.
Những nấm ký sinh chuyên tính chỉ có thể mọc trên mô ký chủ còn sống (như sương mai, phấn trắng và gỉ sắt) và không thể phân lập được trên môi trường nhân tạo. Do đó, việc giám định hình thức biểu hiện ra bên ngoài phụ thuộc vào việc kiểm tra cẩn trọng những bào tử và những cấu trúc tạo bào tử trên mô bệnh.
Nhiều nấm tạo bệnh khác có thể được phân lập và nuôi cấy trong môi trường nhân tạo trong những điều kiện tiêu chuẩn. Những cấu trúc tạo bào tử và bào tử của các nấm bệnh này có thể được để ý trong môi trường nuôi cấy cho những mục đích giám định. Chẳng hạn như đa số những nguyên nhân nấm tạo bệnh ở lá đều sinh ra những cấu trúc tạo bào tử – quả thể, quả cành, đĩa cành, bọc bào tử hoặc cành bào tử phân sinh – và các cấu trúc này đều có thể để ý được dưới kính hiển vi.
Kiểm tra sự hòa hợp sinh dưỡng là một biện pháp khác có thể được sử dụng để xác định dòng. Nghiên cứu khả năng phối hợp trong sinh sản hữu tính cũng hỗ trợ tìm hiểu thêm về sự đa dạng di truyền và có thể được dùng để nhận biết các loài khác nhau nhưng có hình thức biểu hiện ra bên ngoài tương đương. Tuy vậy, các kỹ thuật này yêu cầu nhiều kinh nghiệm và trang thiết bị hơn là tất cả những gì sẵn có trong các phòng thí nghiệm chẩn đoán nhỏ.
8/ Tài liệu tham khảo
Agrios G.N. 2005/ Plant pathology, 5th edition. Elsevier Academic Press: San Diego, California.
Cuốn cẩm nang này được sắp xếp thành những phần sau:
- Phần 1: Phần giới thiệu
- Phần 2: Tổng quát về sức khỏe thực vật và những nhân tố tác động
- Phần 3: Quy trình chẩn đoán nguyên nhân tạo bệnh trong khu vực phòng thí nghiệm và ngoài ruộng đồng
- Phần 4: Những dấu hiệu bệnh cây
- Phần 5: Quy trình và thiết bị làm việc trên ruộng đồng
- Phần 6: Quy trình và thiết bị làm việc trong khu vực phòng thí nghiệm
- Phần 7: Giới thiệu sơ lược về phân loại nấm
- Phần 8: Những biện pháp truyền bệnh nhân tạo
- Phần 9: Quản lý bệnh gây hại tổng hợp
- Phần 10: Những bệnh do nấm có xuất xứ từ đất
- Phần 11: Những bệnh thông thường gặp trên một vài cây trồng có ý nghĩa kinh tế
- Phần 12: Tác động sức khỏe từ nấm tạo bệnh
- Phần 13: Thiết kế, xây dựng và vận hành những phòng thí nghiệm và nhà lưới sử dụng cho chẩn đoán
- Phần 14: Phụ lục về kỹ thuật làm que cấy dẹp, sức khỏe an toàn trong công việc, cũng như những công thức nấu môi trường, những biện pháp tiệt trùng, và những biện pháp lưu giữ mẫu nấm.
– Tham khảo thêm chủ đề: cẩm nang chuẩn đoánbệnh cây, bệnh gây hại cây trồng, bệnh do nấm, kỹ thuật sử dụng kính hiển vi
Ngoài ra, trong bài viết này, chúng tôi có đề cập đến 1 số loại dinh dưỡng và sâu bệnh, quý bà con có thể dụng các loại thuốc sau để điều trị cho cây trồng: – Giúp trị bệnh CHÁY LÁ: azoxy gold 600sl, gamycinusa 75wp, aikosen 80wp, visen 20sc, super tank 650wp, – Giúp trị bệnh GỈ SẮT: super tank, tisabe, thần y trị bệnh, sat, map rota, haohao, new kasuran 16.6wp, longbay, ridomil gold, daconil, – Giúp kích thích nảy mầm NẢY MẦM: ademon super 22.43sl, dekamon 22.43l, root plex, – Giúp trị bệnh NẤM BỆNH: agri-fos 458 blue, agri-life 100sl, aikosen 80wp, alpine 80wdg, amistar 250sc, amistar top 325sc, amtech 100ew, antracol 70wp, anvil 5sc, athuoctop 480sc, – Giúp trị bệnh PHẤN TRẮNG: elcarin, daconil 500sc, picoraz 490ec, longbay 20sc, tisabe, champion 57.6dp, athuoctop 480sc, caligold 20wp, sunshi, thần y trị bệnh, – Giúp trị bệnh SƯNG RỄ: tervigo 020 sc, mocabi, actinovate 1sp, – Giúp trị bệnh SƯƠNG MAI: super tank 650wp, bordeaux 25wp (booc đô), map rota 50wp, map hero 340wp, thalonil 75wp, forliet 80wp, gekko 20sc, mataxyl 500wp, melody duo 66,75wp, phytocide 50wp, – Giúp trị bệnh THỐI RỄ: profiler 711.1wg, jialeton, acrobat mz, actinovate 1sp, super tank, tisabe, agri-fos 458 blue, sat 4sl, alpine 80wdg, eddy 72wp, – Giúp trị bệnh THỐI THÂN: physan lạnh 20sl, alpine 80wdg, aragibat liên việt, actinovate 1sp, daone 25wp, agofast 80wp, aikosen 80wp, caligold 20wp, elcarin 0.5sl, super tank 650wp, – Giúp đặc trị TUYẾN TRÙNG: tervigo 020 sc, map logic 90wp, vk sudan 750ec (mãnh hổ), velumprime 400sc, tiêu tuyến trùng 18ec, actinovate 1sp, azadi neem, thiacyfos 600ec, chitosan super, actinovate 1sp, – Giúp trị vi khuẩn VI KHUẨN : avalon 8wp, kasumin 2sl, k.susai 50wp, kufic 80sl, rorai 21wp, dũng sĩ diệt khuẩn, visen 20sc, daone 25wp, yomisuper 22sc, actinovate 1sp, – Giúp trị bệnh ĐỐM LÁ : daone 25wp, anvil 5sc, daconil 500sc, caligold 20wp, cyzate 75wp, athuoctop 480sc, agri life 100sl, amistar 250sc, miksabe 100wp, super cook, – Giúp trị bệnh ĐỐM VÒNG: overamis, elcarin, tisabe, sat, thalonil 75wp, zineb bul, haohao, azoxy gold, longbay, super tank,
Nhấp vào nút Mua Nhanh bên dưới để đặt mua qua chúng tôi.
LIÊN HỆ MUA HÀNG : 0969.64.73.79